後根神経節 (DRG) 神経細胞培養からは、in vivoで見られる化学的、及び熱感受性が示されます。 マイクロエレクトロードアレイ (MEA) プレート上で、これらの細胞を in vitro で培養し、その電気的な活動を検出することが可能です。マルチウェルフォーマットの Maestro MEA システムでは、複数の試験条件で長期間に渡り評価できるため、慢性的な神経障害疼痛の研究などに最適です。
痛みの感覚は、感覚神経終末部から中枢神経系に伝達されます。この伝達を担うのは末梢神経細胞の軸索で、その細胞体は後根神経節(DRG)に位置しています。これら一次求心性神経細胞の損傷、或いはその電気的・感覚機能の基礎となるタンパク質の損傷は、DRGニューロンの自発発火を増加させ、持続的な痛覚である神経障害性疼痛を引き起こします。
-
MEAによるカプサイシン誘発 DRG ニューロンの一時的・持続的発火頻度上昇検出>
-
論文ハイライト: 痛みの研究>
-
TRPV1アンタゴニストによる、カプサイシン誘発DRG活性の抑制>
-
MEA システムによる、DRG神経細胞温度感受性の測定>
-
肢端紅痛症モデル神経細胞の温度上昇による活性と薬剤による抑制>
-
アッセイの手順>
DRGニューロンは、化学物質、有害な熱や冷感、炎症によるpHの変化などの刺激に対して、異なる感受性を示します。これらの感受性は、イオンチャネル型受容体であるTRP チャネルに大きく影響されており、特に重要とされるのはTRPV1チャンネルです。TRPV1チャンネルは、有害な熱やpHに対する主要な受容体であり、高体温症や炎症性疼痛に関与しています。
唐辛子の活性成分であるカプサイシンは、ヒトにとっては化学的刺激物であり、接触した組織に灼熱感をもたらします。カプサイシンは、TRPV1受容体のアゴニストであり、DRGニューロンを活性化させます。本事例では、MEAプレート上にDRG 神経細胞 (1 x 104 cells/well) を培養し、培養開始から7日目に、Axion MEA システムにて電気的な活動を測定しました。平均発火率 (Mean Firing Rate, MFR) の変化により、カプサイシン (100 nM) の影響が評価されました。
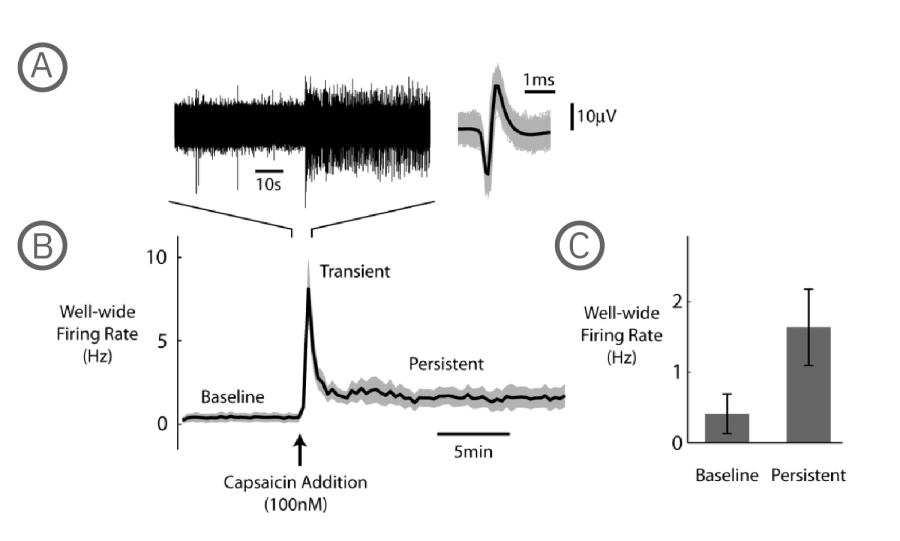
A) 左図は1電極よりられた生電位データ、右図は検出されたスパイク波形を示す(グレ-は全波形、黒は平均波形) 。 B) カプサイシン投与前後の Well 内 発火率(N=6 well、平均を黒、標準誤差をグレーで示す)。カプサイシン投与により、自発発火率は一時的に大きく上昇した (Transient) 後に減少し、投与前より高い状態で10分程持続した (Persistent)。 C)カプサイシン投与前、投与後 (Persistent) 各フェーズの発火率(3分間の平均)。投与後の発火率上昇が示された(N=6、p=0.313、Wilcoxon Signed Rank Test、エラーバーは標準誤差を示す)。
Axion マルチウェル MEA システムと神経細胞解析モジュールの組み合わせで、DRG神経細胞における、カプサイシンによる発火頻度上昇を、簡単に検出・解析して頂けます。

論文ハイライト: 痛みの研究
慢性疼痛に対する個別化医療のニーズは高まっています。本書では、Maestro プラットフォームが、幹細胞モデル、個別化医療、新しい治療標的探索などに使用された5本の論文が紹介されています。
カプサイシンによるDRGニューロンの活性は、in vitro モデルにおいて高い再現性が示されています。これにより、活性を阻害する疼痛治療化合物のスクリーニングアッセイが可能になります。
DRGニューロン (1 x 104 cells/well)を、MEAプレート 内の異なる2well内で培養し、7分間のカプサイシン処理 (100 nM) を行い発火率を上昇させました。20分後、1 wellに、TRPV1競合阻害剤であるデヒドロアンドロステロン(DHEA)を10 mM 投与しました。DHEAを投与したDRGニューロンの発火率は、非投与well内のDRGと比較して有意に減少し、従来のパッチクランプ研究の結果と一致しました。DHEA曝露による発火減少の10分後に1mMのカプサイシンを添加したところ、その効果は逆転し、TRPV1受容体の感受性は持続されていることが示されました。
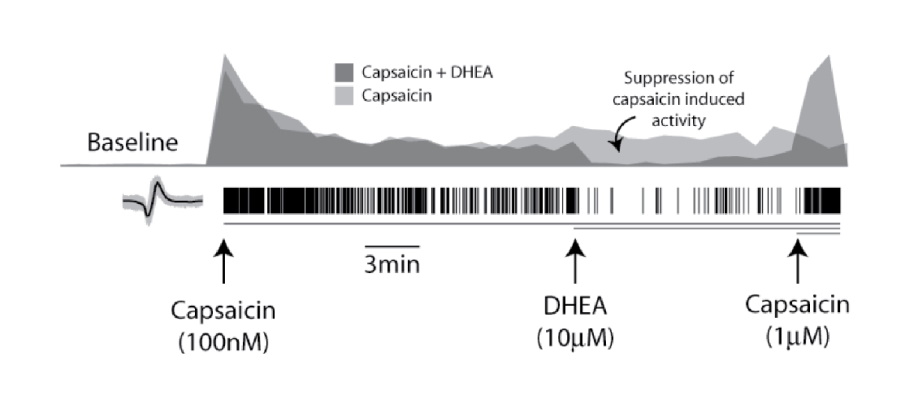
ヒストグラムは、well内の発火率(カプサイシン誘発活性を基準としてノーマライズ、bin size=60 sec) を示す。更に高濃度のカプサイシン(1μM)投与により、DHEA(濃グレー)による抑制効果は減少した。
Axion マイクロエレクトロードアレイシステムにより、カプサイシンによるDRGニューロンの活性化、及び疼痛化合物による抑制を、ハイスループット環境下で評価して頂けます。
TRPV1チャネルのコンフォメーションは、有害な熱により変化します。43℃を超える温度はTRPV1チャネルの活性化閾値を下げ、神経細胞の興奮性を増加させます。 Maestro MEAシステム は、装置内蔵のコントローラを使用してMEAプレートを直接加温するため、DRG神経細胞の熱に対する応答評価が容易です。本事例では、Offline Sorter (Plexon社製)を用いたスパイクソーティングと、Neural Metric Toolによる解析で、5個の DRG 神経細胞の熱反応が解析されました。
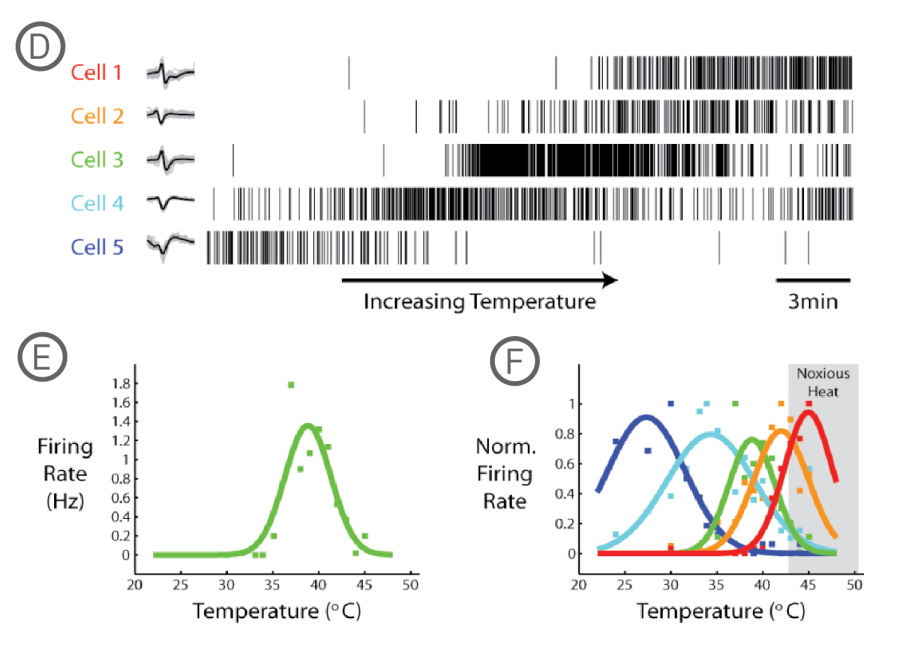
D) 5個の異なるDRG神経細胞のスパイクラスタープロット。測定中に温度を24℃から45℃に上昇させた。 E) 各温度における、Cell 3 (緑色)の平均発火率(ガウシアンカーブ、bin size = 60 sec、にて算出)。F) ノーマライズされた5細胞の発火率。各細胞ごとに異なる温度感受性を持つことが示された。
Maestro MEAシステムは、温度コントローラが内蔵されています。このため、環境温度の変更が容易で、DRG神経細胞の温度感受性の検出に有用です。
肢端紅痛症は、主に手足に現れる慢性疼痛症候群で、温度上昇に対する強い痛み反応で知られています。本研究では、その原因遺伝子であるNav1.7-S241変異を発現させたDRG 神経細胞をMEAプレート上に培養し、電気的な活動を測定しました。カルバマゼピン (CBZ) の投与により、温度上昇による発火頻度の上昇が抑制されました。また、同変異を持つ2人の患者にカルバマゼピンを投与したところ、プラセボと比較して痛みの持続時間が減少しました。 [Mis et al. 2018]
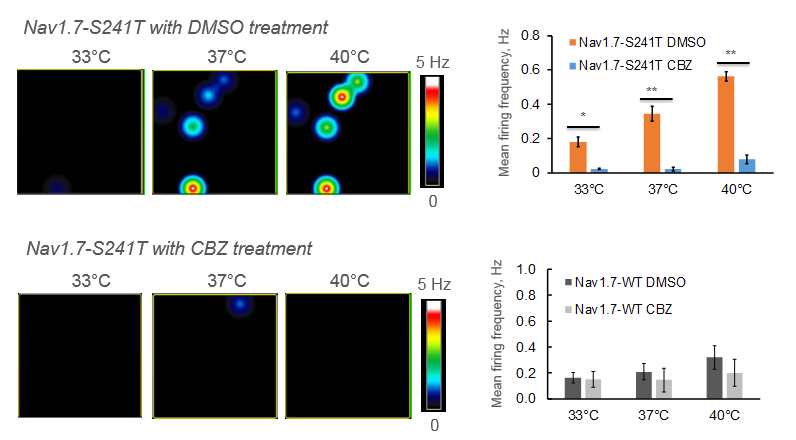
Maestro マイクロエレクトロードアレイ では、 マルチウェル MEA プレート の直接加温が可能です。本研究では、肢端紅痛症モデル神経細胞の発火頻度の温度上昇による変化と、薬剤による抑制が測定されました。
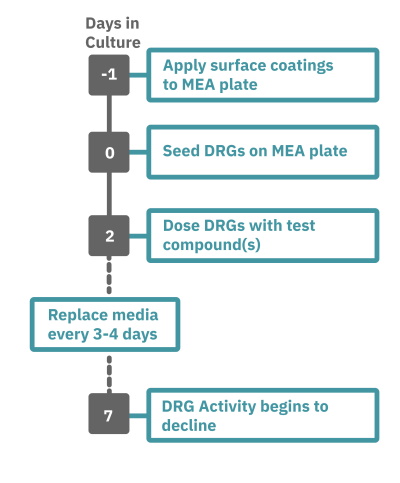
Maestro Pro 、Edge によるアッセイは非常に簡単です。
コーティングされた マルチウェル MEAプレート上にDRG 神経細胞を播種し(Day 0)、培養します。
一定期間の培養の後、MEA プレートを Maestro に搭載し測定を行います。装置内蔵温度コントローラにて環境温度を調節します。データはAxIS Navigator 神経ジュールソフトウエアにてで解析します。




